2019.05.12 14:07
2019高考进行备考阶段,新东方在线高考网小编整理了2019高考化学必备知识点,供同学们参考。点击下载>>高考复习资料
新东方在线推出了48道题测出最适合你报考的大学专业 参考适合你填报的大学专业。 估分选大学,通过大数据,选出适合你报考的大学。
2019高考化学必备知识点:溶液的酸碱性与PH值
1.溶液的酸碱性
溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。
酸性溶液中:c(H+)>c(OH-)
中性溶液中:c(H+)=c(OH-)
碱性溶液中:c(H+)
2.混合溶液酸碱性的判断规律
(1)等浓度等体积一元酸与一元碱混合的溶液——“谁强显谁性,同强显中性”
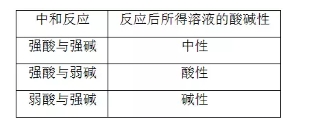
(2)室温下,已知酸和碱pH之和的溶液等体积混合
(1)两强混合
①若pH之和等于14,则混合后溶液显中性,pH=7。
②若pH之和大于14,则混合后溶液显碱性,pH>7。
③若pH之和小于14,则混合后溶液显酸性,pH<7。
(3)一强一弱混合——“谁弱显谁性”
pH之和等于14时,一元强酸和一元弱碱等体积混合呈碱性;一元弱酸和一元强碱等体积混合呈酸性。
3.溶液的pH

(3)pH试纸的适用范围:0~14
(4)pH试纸的使用
①方法:把小片试纸放在表面皿上,用玻璃棒蘸取待测液点在干燥的pH试纸上,试纸变色后,与标准比色卡对比即可确定溶液的pH。
②注意:pH试纸使用前不能用蒸馏水润湿,否则待测液因被稀释可能会产生误差。广泛pH试纸只能测出整数值。
4.关于pH的计算
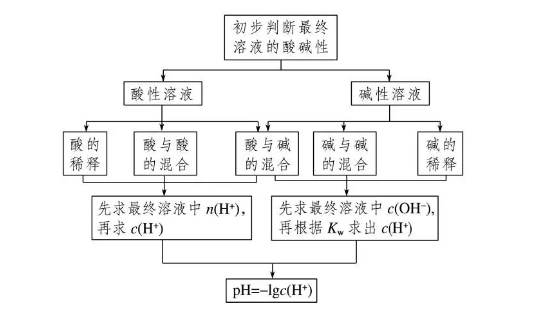
5.酸、碱稀释时两个误区
(1)不能正确理解酸、碱的无限稀释规律
常温下任何酸或碱溶液无限稀释时,溶液的pH都不可能大于7或小于7,只能接近7。
(2)不能正确理解弱酸、弱碱的稀释规律
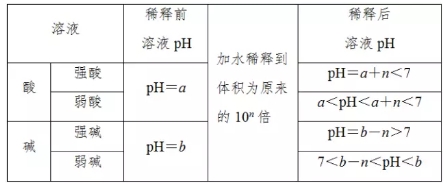
新东方在线小编整理了历年高考试题及答案、高考分数线、高考作文、高考满分作文、2018高考录取分数线汇总 、2018高考录取投档线、2018高考一分一段分段表,供参考。
| 新东方在线高考地方站 | |||||||
| 北京 | 天津 | 河北 | 山西 | 内蒙古 | 辽宁 | 吉林 | 黑龙江 |
| 上海 | 江苏 | 浙江 | 安徽 | 福建 | 江西 | 山东 | 河南 |
| 湖北 | 湖南 | 重庆 | 四川 | 贵州 | 云南 | 西藏 | 陕西 |
| 甘肃 | 青海 | 宁夏 | 新疆 | 广东 | 广西 | 海南 | |

扫码预约一对一精华课
资深教师+1对1定制教学
