2019.05.02 10:05
2019高考进行备考阶段,新东方在线高考网小编整理了2019高考化学知识点,供同学们参考。点击下载>>高考复习资料
新东方在线推出了48道题测出最适合你报考的大学专业 参考适合你填报的大学专业。 估分选大学,通过大数据,选出适合你报考的大学。
2019高考化学知识点:氧化还原反应的特性
氧化还原反应:
第一次接触氧化还原反应应该是在初中学习高炉炼铁时:
Fe2O3+ CO = Fe + CO2
在描述这个反应的时候,我们会说“CO将Fe-2O3还原成了Fe”。而对于S与O2反应时,我们会说O2把S氧化成了SO2。此时,我们认为是氧气把硫单质给氧化了。此时,我们认为“O2可以将其他物质氧化,而H2、CO可以将氧化物还原”。
到了高中,由于之前对于氧化还原的定义受限于氧元素,对于不含氧元素的物质不适用。所以我们对这个概念进行了扩展。
氧化还原反应的特征:反应前后元素的化合价具有相应变化的反应称作氧化还原反应。注:这是判断反应是否为氧化还原反应的判据。
氧化还原反应的实质:对于化合价的变化我们理解为是电子的转移。所以氧化还原反应的实质就是电子的转移。。
相关概念:
以高炉炼铁反应为例

氧化剂:反应物中,化合价降低的物质称作氧化剂。
还原剂:反应物中,化合价升高的物质称作还原剂。
氧化产物:生成物中,化合价升高的物质称作氧化产物。
还原产物:生成物中,化合价降低的物质称作还原产物。
注1:同一反应中可能出现两种或以上氧化剂(还原剂、氧化产物、还原产物)。
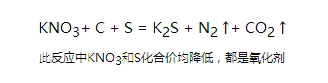
注2:同一物质可以既是氧化剂又是还原剂,也可以既是氧化产物又是还原产物。

注3: 氧化剂得到电子、化合价降低、变成还原产物;
还原剂失去电子、化合价升高、变成氧化产物。
电子转移的表示方法:
双线桥
箭头由氧化剂指向还原产物、还原剂指向氧化产物。标清得失电子以及电子数目。
单线桥
箭头由还原剂指向氧化剂,标清电子数目。
氧化还原反应的应用
反应顺序
多种氧化剂和多种还原剂同时存在时,最先发生发应的是氧化性和还原性最强的物质
特殊的氧化还原反应
归中反应:氧化产物和还原产物为同一物质

歧化反应:氧化剂和还原剂为同一物质
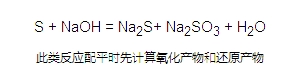
氧化性、还原性强弱的判断
在一个方程式中,氧化性强弱顺序为:氧化剂>氧化产物>还原产物>还原剂
还原性强弱顺序为:还原剂>还原产物>氧化产物>氧化剂
氧化还原反应相关计算
参与反应的物质
转移电子数
新东方在线小编整理了历年高考试题及答案、高考分数线、高考作文、高考满分作文、2018高考录取分数线汇总 、2018高考录取投档线、2018高考一分一段分段表,供参考。
| 新东方在线高考地方站 | |||||||
| 北京 | 天津 | 河北 | 山西 | 内蒙古 | 辽宁 | 吉林 | 黑龙江 |
| 上海 | 江苏 | 浙江 | 安徽 | 福建 | 江西 | 山东 | 河南 |
| 湖北 | 湖南 | 重庆 | 四川 | 贵州 | 云南 | 西藏 | 陕西 |
| 甘肃 | 青海 | 宁夏 | 新疆 | 广东 | 广西 | 海南 | |

扫码预约一对一精华课
资深教师+1对1定制教学
